Transparisation des tissus
Pourquoi transpariser ?
La microscopie optique classique permet d’imager sans difficulté des marqueurs fluorescents présents dans un tapis cellulaire ou encore dans une coupe fine (5-10µm). Cependant, au delà d’une certaine épaisseur (jusqu’à environ 70-100µm), la pénétration de la lumière dans un échantillon biologique devient limitée. En effet, un tissu biologique est opaque : sa composition est hétérogène et ses différents composés présentent des indices de réfractions différents, comme les protéines (1,38-1,43), l’eau (1,33) et les lipides (1,39-1,48). Lors de l’accumulation des interfaces entre ces différents composés, la lumière est trop diffusée, ce qui entraîne une perte de la résolution axiale et une perte de l’intensité du signal. De plus, les pigments présents dans les tissus biologiques (comme l’hémoglobine, la myoglobine ou encore la mélanine) absorbent la lumière et empêchent sa pénétration. Ainsi, pour rendre transparent un tissu il sera nécessaire d‘en homogénéiser les indices de réfraction afin de limiter la diffusion de la lumière. Par exemple, les interfaces lipido-aqueuses contribuent à créer des hétérogénéités d’index de réfraction dans les différents compartiments cellulaires, c’est pourquoi certaines méthodes de transparisation des tissus se basent sur l’élution des lipides. On pourra également décolorer le tissu pour limiter l’absorption de la lumière si différents pigments sont présents.
Pour finir, il faudra immerger le tissu dans une solution proche de son indice de réfraction (“refractive index matching”), compatible avec le système d’imagerie utilisé.
Quelles méthodes ?
Un grand nombre de méthodes existent, qui sont couramment séparées en deux grandes catégories : les méthodes utilisant des solvants organiques (ex : IDISCO) et celles utilisant des solvants aqueux. Parmi les méthodes basées sur l’utilisation de solvants aqueux, on peut retrouver les méthodes par immersion simple avec des solutions à haut indice de réfraction (ex RapiCLear), les méthodes basées sur l’hyper-hydratation des tissus (ex : CUBIC) et enfin les méthodes basés sur l’intégration d’un hydrogel dans le tissu (ex: Clarity). 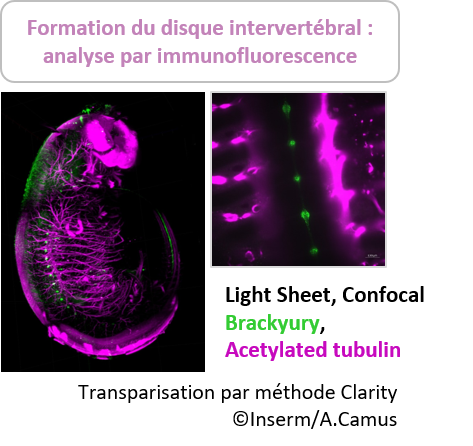
La plupart des méthodes utilisant des solvants organiques sont basé sur la déshydratation du tissu et provoque l’extinction de la fluorescence endogène. Au contraire, celles utilisant des solvants aqueux permettent la préservation de la fluorescence endogène, qui peut cependant être plus ou moins réduite selon la méthode utilisée.
Le choix de la méthode de transparistion et du système d’imagerie
La méthode de transparisation choisie va dépendre de la taille de votre échantillon, du marquage observé (protéine fluorescente native ou immunomarquage) et le système d’imagerie utilisé (microscopie confocale, microscopie à feuille de lumière,…).
Sur la plateforme MicroPICell, nous conseillons pour transpariser des petits échantillons (type coupe épaisse, sphéroïde, organoïde…) jusqu’à environ 600 µm d’utiliser des méthodes par immersion simple avec des solutions à haut indice de réfraction. Cette méthode consiste à laisser simplement l’échantillon immergé dans une solution à haut indice de réfraction. Progressivement, cette solution va remplacer les molécules d’eau présentent dans le tissu par pression osmotique et élever l’indice de réfraction qui sera plus proche des composants cellulaires. La plupart de ces méthodes n’entraîne pas/peu d’altération du tissu (expansion/rétrécissement), conserve la fluorescence endogène et est compatible avec des marquages immunofluorescents.
Cette méthode est plutôt adaptée aux petits échantillons (transparisation en quelques heures pour coupes épaisses, sphéroïdes...) car sur des plus gros échantillons type organes de souris entiers, elle est longue et moins efficace.
Une fois transparisés, les échantillons de cette taille pourront être imagés en microscopie confocale grâce aux objectifs à longue distance de travail disponibles sur nos équipements.
Exemples de solutions utilisées: RapiClear, TDE, …
Pour de plus gros échantillons comme des organes entier de souris, nous avons à disposition la méthode Clarity (détaillée dans l’onglet du système X-Clarity ). Cette technique repose sur l’élution des lipides d’un échantillon par une solution SDS, sous l’action d’une électrophorèse. L’imprégnation au préalable de l’échantillon dans un hydrogel à base d’acrylamide permet de conserver la structure et le contenu cellulaire du tissu.
Cette méthode conserve les protéines natives fluorescentes type GFP et est compatible avec des marquages immunofluorescents. Elle entraîne cependant un gonflement du tissu.
Elle a déjà été validée pour une grande variété d’échantillons de souris : intestins, cerveau, poumon, os, tumeur…
La visualisation de gros échantillons transparisés se fera avec le microscope à feuille de lumière pour une taille d’échantillon maximum d’environ 2 cm.



